AMIS-101 の検出原理(化学反応を電気信号にダイレクトに変換する、ラベルフリー)
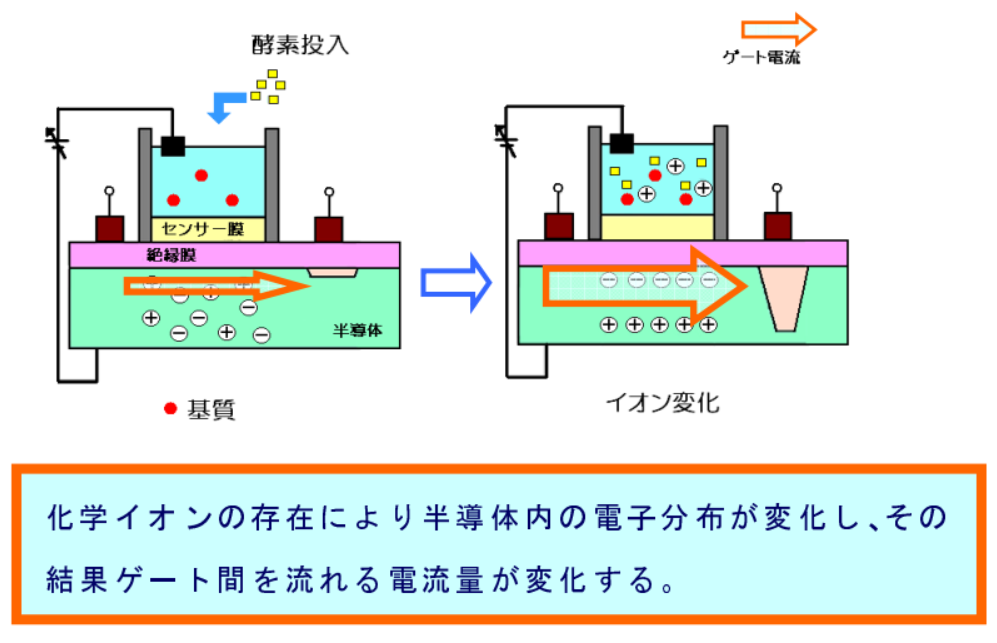
AMIS センサー(注)は下図のようにセンサー膜上に反応セルを設置した構造をとっており、反応セル内における化学反応によって生ずる水溶液(あるいは懸濁液)中のプロトンの増減(水素イオン濃度の変化)が電界として半導体内の電子分布状態に影響を与え、結果として半導体の電流量の変化として検出される。
(注)AMIS ・・・Accumulation Method Ion Sensor 信号累積型イオンセンサー
容易に測定できる系
水溶液又は懸濁液中の化学反応、生化学反応
(例:酵素反応、タンパク代謝反応、微生物代謝反応、一般化学反応)
酵素反応や酵素反応を応用した反応の測定の場合は従来のような複雑な発光、発色プロセスを必要とせず、反応をダイレクトに電気信号に変換するため、ラベルフリーでシンプルな測定が可能である。
そのままでは測定できない系
電荷の増減、構造の変化などの物理的な変化で溶液中のプロトンの増減に結びつかない現象、プロトンの増減を伴わないイオン変化量
(例:タンパクの凝集・分散、タンパクの構造変化、抗原-抗体反応)
この様な系では試薬などによってプロトンの増減に変更する工夫・検討を加える必要がある。
AMIS-101 の特徴
同一センサーで様々な測定系に対応
AMIS センサーはイオン選択性のセンサーとは異なり、目的に応じた試薬を選択することによって様々な反応系に対応することができる。(別紙データ集参照)
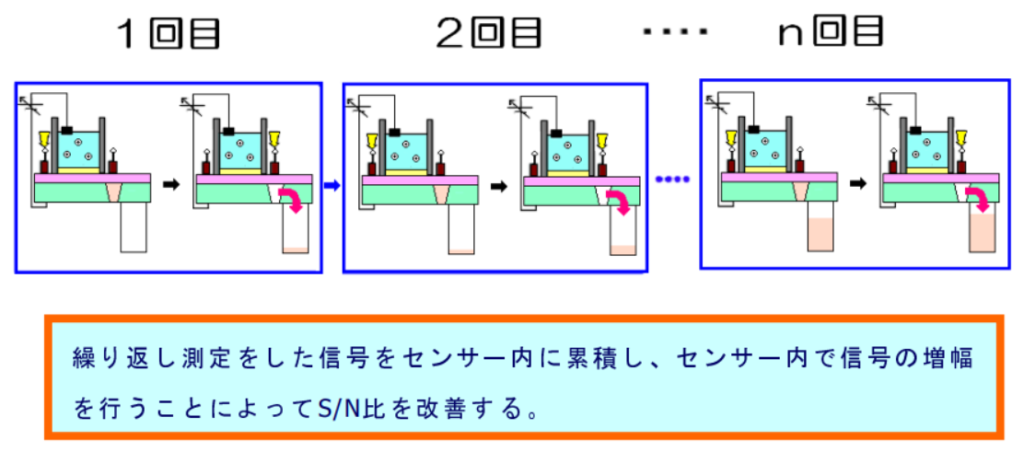
高感度測定が可能
AMIS センサーは CMOS 構造を採用し、センサー内に電荷として蓄積し、センサー内で信号を増幅した後に取り出すため S/N 比が改善されるため、高感度の測定が可能である。
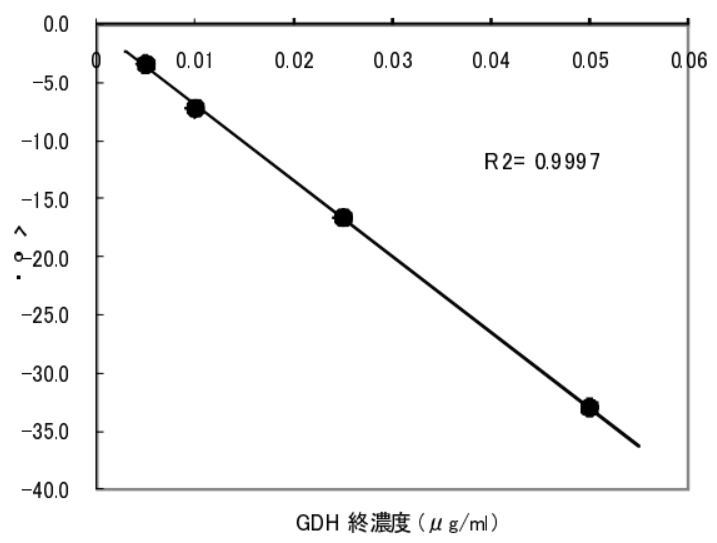
高感度測定の例
基質グルコース(5mg/ml)中で反応させたグルコース脱水素酵素(GDH)活性測定の限界濃度は約 5ng/ml (5ppb)であった。
微量測定が可能
センサーの反応セルへの試料投入量は 10-20 マイクロリットルであり微量サンプルの測定が可能である。
微量測定の例
上記グルコース脱水素酵素活性測定に必要な酵素量は
5ng/ml×0.02ml = 0.1ng (約 1 フェムトモル)
となる。
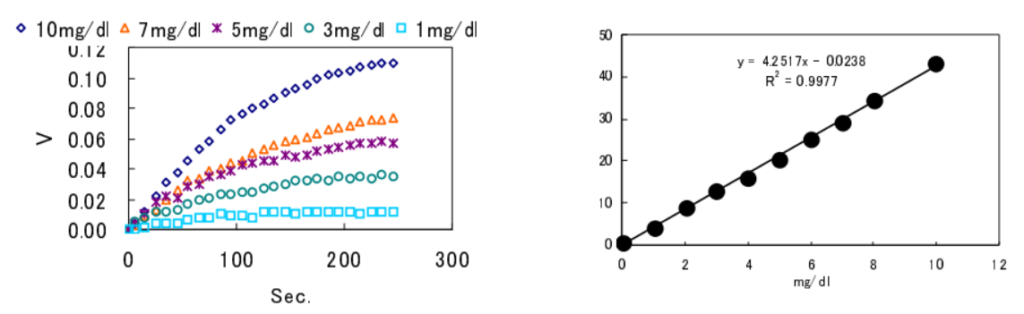
リアルタイムに反応を観察
反応がリアルタイムで観察でき、5 分程度の短時間で定量分析が可能となる。
リアルタイム測定の例
クレアチニンデイミナーゼによるクレアチニンの検出

酵素溶液(0.1mg/ml) 18μリットル(酵素量 1.8μg)×2 (サンプル+ コントロール)
基質(0.01mg/ml) 2μリットル(基質量 20ng)
測定事例集
京都市産業技術研究所におけるリパーゼ測定 京都市産業技術研究所におけるリパーゼ測定
疾患の診断やバイオディーゼルの製造など臨床的にも産業的にも重要な酵素であるリパーゼの簡便な活性測定で、酵素反応により生成する遊離の脂肪酸を検出することによって酵素活性を定量的に分析することが可能であった。
Lipoprotein Lipase の活性測定
[反応機構]
Lipoprotein Lipase による Olive oil の加水分解の結果生じるオレイン酸を検出
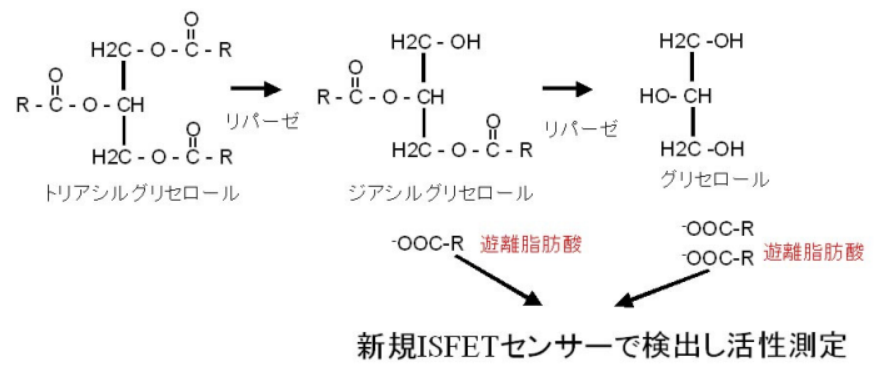
[使用試薬]
酵素:Lipoprotein Lipase (TOYOBO LPL311)
基質:トリアシルグリセロール(Olive oil):3mg/ml Buffer+超音波処理
[結果]
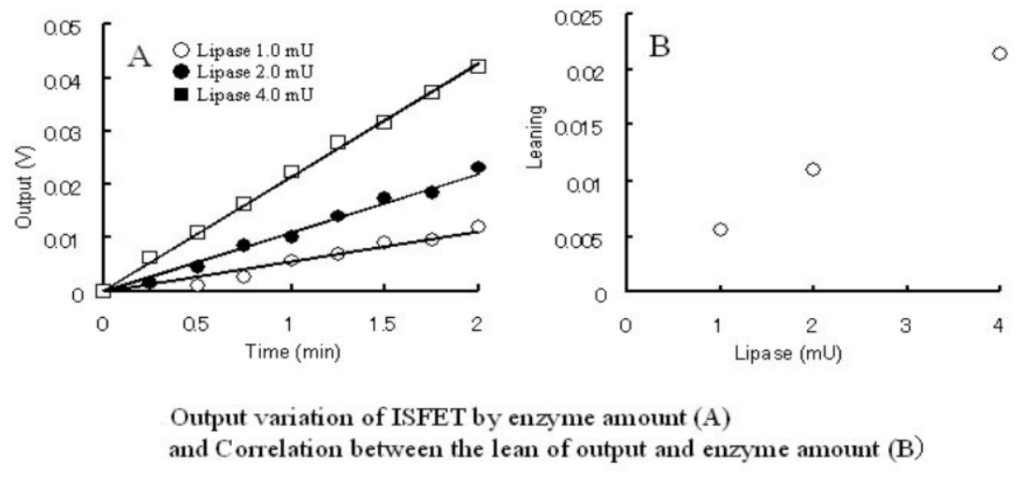
今回用いた酵素量の範囲では酵素量とシグナル変化の傾きは比例関係にあり,定量的に酵素活性を測定できることが確認できた。
リパーゼ特性解析方法
トリアシルグリセロールをリパーゼによって加水分解すると,リパーゼの種類によって遊離の脂肪酸以外にも,ジアシルグリセロール,モノアシルグリセロール,グリセロールなどが生成される。ここで用いた Lipoprotein Lipase はトリアシルグリセロールをグリセロールまで完全に加水分解する特性を有する。生成したグリセロールをリン酸化しさらに酸化することにより生成するジヒドロキシアセトンリン酸等の化合物を検出した。
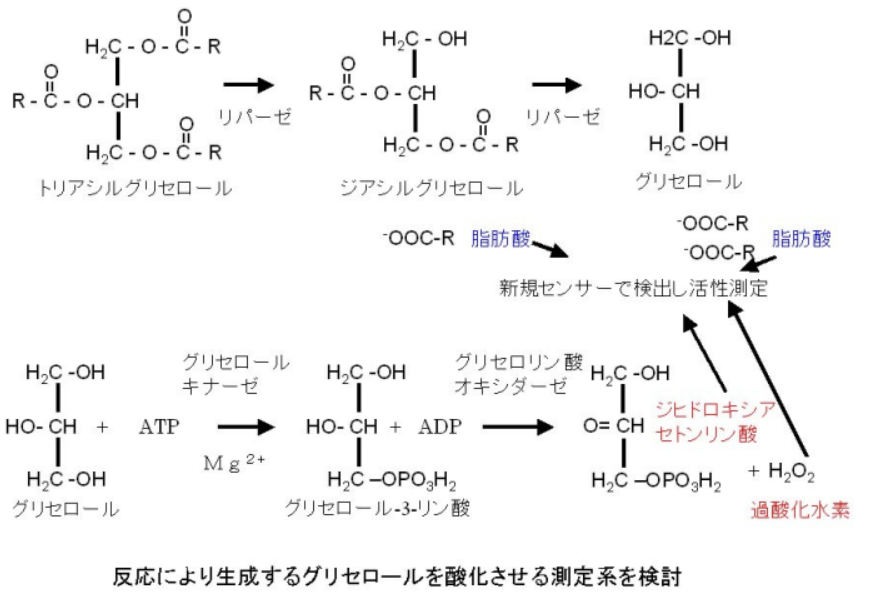
グリセロールのリン酸化にはグリセロールキナーゼを,リン酸化したグリセロールの酸化はグリセロリン酸オキシダーゼをそれぞれ共役酵素として添加する反応系を構築し,共役酵素を添加しないものと添加したものとのシグナル変化値の比較を行ったところグリセロール酸化系を用いることにより反応のシグナル変化の増加が確認できた。従来分光光度計では測定困難であった分析分野へ応用することが可能であることが確認できた。
[結果]
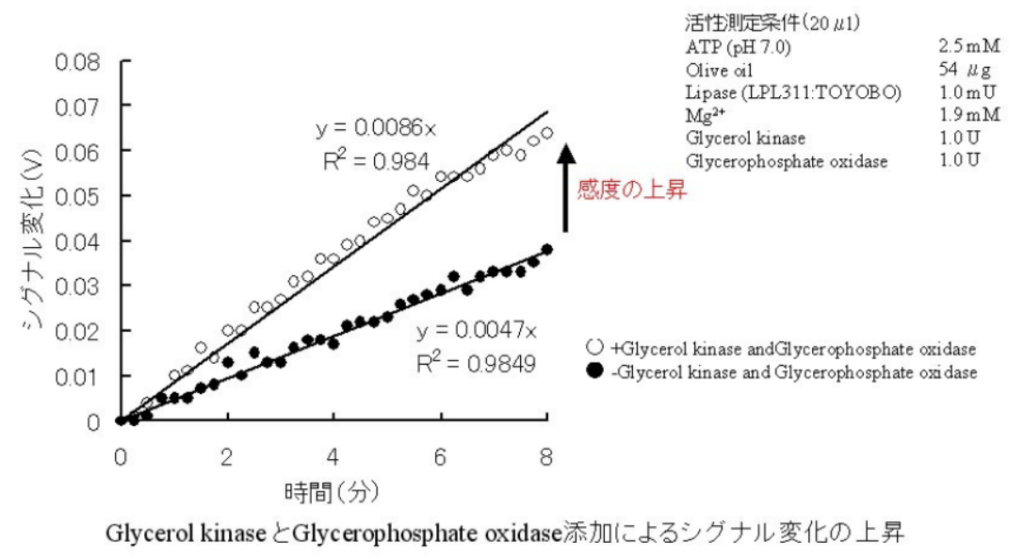
⇒反応に寄るグリセロール生成に関してリパーゼの特性解析が可能
産総研(独立行政法人産業技術総合研究所 関西センター)による評価報告
グルコース濃度の測定
グルコースオキシダーゼはグルコースを酸化し、グルコノラクトンと過酸化水素を生じる反応を起こす。グルコノラクトンは直ちに分解して、グルコン酸が生じる反応を起こす。
[使用試薬]
酵素:グルコースオキシダーゼ
基質:各濃度のグルコース溶液
[結果]
グルコース濃度に依存して出力変化量が大きくなった。グルコースが多いほど、より酸性となって、ISFET の応答がより大きくなったといえる。空腹時の正常血糖値80-100mg/dl(=0.8-1g/L)を十分に測定できる感度を持つことが示された。
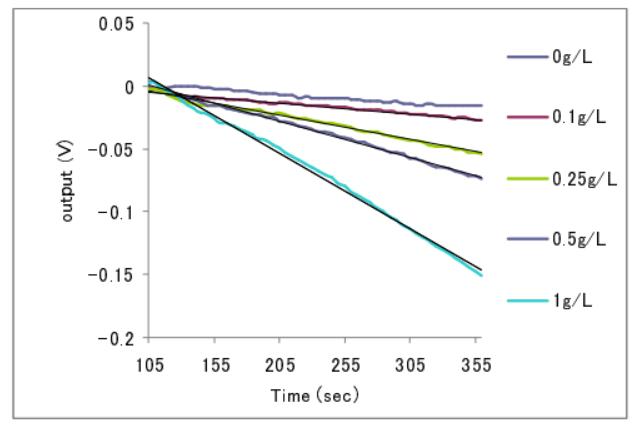
へキソキナーゼによる ATP 分解反応の測定 ATP 分解反応の測定
ヘキソキナーゼは、グルコースやフルクトースなどの糖および ATP を基質として、糖の 6 位のヒドロキシル基に ATP のγ位のリン酸を転移し、糖のリン酸エステルにする反応を触媒する ATPase 酵素の一種である。グルコースを用いてグルコース 6 リン酸が生成する際の pH 変化を測定した。同時に比較ため NAD を用いた吸光度法による測定を行った。
〔実験法〕
AMIS-101 による測定:
ヘキソキナーゼ(5U/mL、6μ L)、塩化マグネシウム(30mM、6μ L)、ATP(1.6mM、6μ L)に、グルコース(1g/L、2μ L)を加えて測定した
吸光度法による測定:(測定が可能な量まで増量している)
NAD(6.8mM、0.1mL)、ATP(16.5mM、0.1mL)、グルコース 6 燐酸デヒドロゲナーゼ(300U/mL、0.01mL)、グルコース3.35mM、0.25mL)、塩化マグネシウム(13.4mM、2.3mL、50m M-trisHClpH8)、水 0.25mL、にヘキソキナーゼ(116U/mL、0.01mL)を加えた際の 340nm の吸光度変化を測定した。
〔結果〕
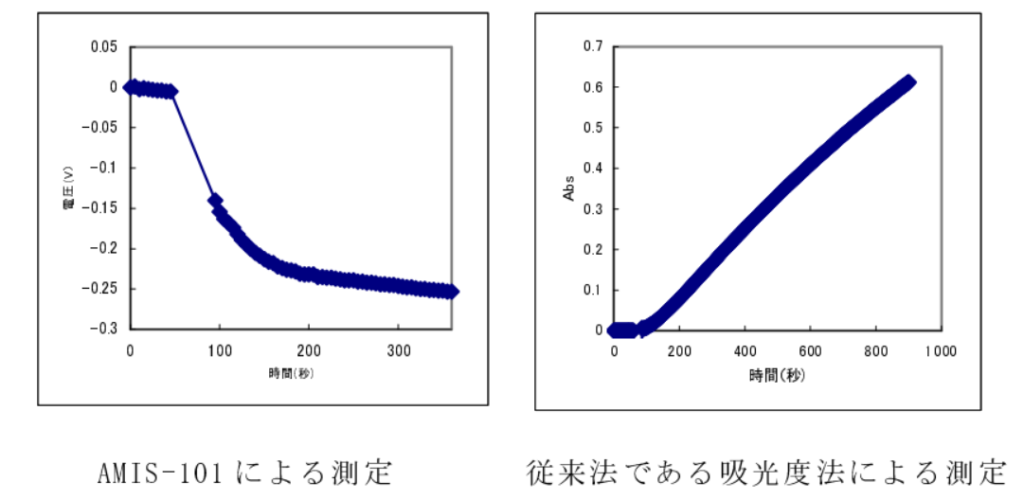
反応が開始すると直ちに、AMIS-101 の出力は下がり始めた(pH が酸性にずれていった)。これは、ATP から ADP とリン酸エステルが生成し、リン酸部位の濃度が増大するためであると考えられる。また、従来法である吸光度法では、基質および反応生成物には吸光度変化は起こらないため、生成物であるグルコース 6 リン酸をグルコース 6 燐酸デヒドロゲナーゼにより NAD と反応させ、生成する NADH に転換しこの紫外吸収を測定することが行われている。この場合、3mL の試料量が必要である。
以上のように、ISFET センサーは少量の試料で簡便にヘキソキナーゼの活性測定が行えることが示された。
ミオシン蛋白質の ATP 加水分解反応の ATP 加水分解反応の測定
ミオシンは ATP を加水分解する酵素であり、その活性測定は後述のように複雑である。本装置の優位性を検証するためミオシンの蛋白質濃度とセンサー出力の関係を調べた。
〔実験法〕
前処理:
ミオシンの ATPase 活性を増強するためサイトスケルトン社の Actin 測定 filament (ウサギの骨格筋、AKF99)を添加した。
測定条件:
2mM Tris-Cl pH8.0、25mM KCl、10mM MgCl2、 0.2mg/ml Actin filament (ミオシン蛋白質の活性促進剤)、0.025~ 0.1mg/ml のミオシン溶液を含む 20μ l を ISFET センサーに添加、最終濃度 10mM ATP となるように ATP 溶液(pH8.0)を添加し反応を開始した。
〔結果〕
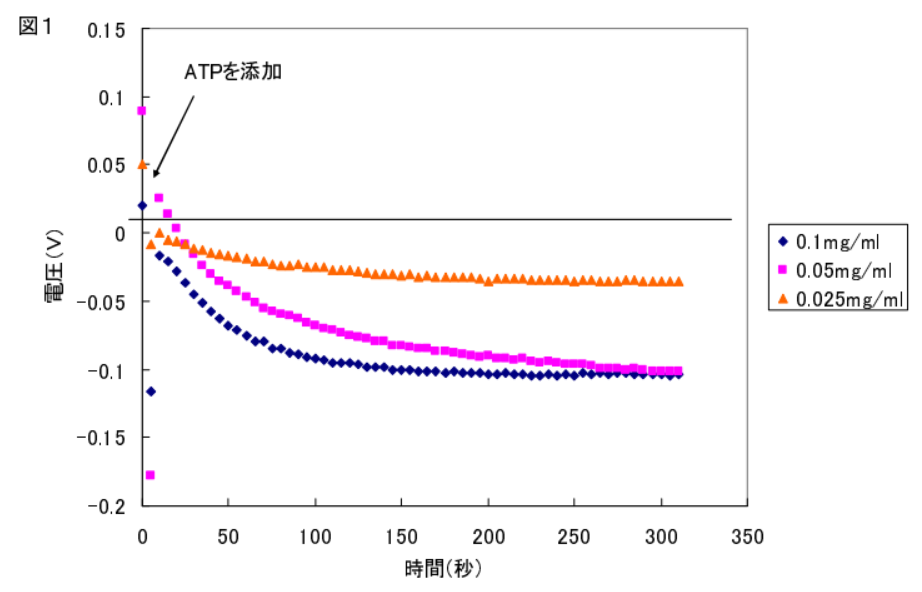
ミオシンが ATP を消化すると、ADP とリン酸が生成するため、pH は酸性に変化すると考えられる。ミオシンの濃度依存的に ISFET センサーの出力の変化量は大きくなったことから、明らかに ATPase 活性由来の反応である事が示唆された。
少なくともミオシンの ATPase 活性はミオシン濃度が 0.025mg/ml でも十分に検出できるだけの高感度を持ち合わせていることがわかった。
従来用いられているモリブデン法では反応に一時間、発色に 20 分間、もろもろの操作を入れれば優に 2 時間を越える実験時間が必要であるが、AMIS-101 ではわずか 5 から 6 分で反応を解析することができた。
京都大学農学研究科との共同研究による食品分析測定
グルコース定量による グルコース定量によるラクトース(乳糖)濃度の測定
牛乳や母乳など哺乳類の乳汁に含まれている糖であるラクトースは、大抵の大人の腸内でのラクトース分解酵素であるラクターゼの分泌が少ないことから、乳製品を摂取した場合に便が緩くなるなどの乳糖不耐症の症状を発症ことが多い。しかし、現在ラクトース定量における公定法として認められている、レイン・エイノン法で高い定量性を得るには、熟練した技術が必要であるとされている。 そこで、ここでは AIMS-101 を用いることによるラクトース定量の簡便性の向上および、ラクトース検出感度の向上についての検討を行った。
[反応機構]
酵素β- ガラクトシダーゼでラクトースをガラクトースとグルコースに分解し、生産されるグルコースをグルコース脱水素酵素で分解し、グルコン酸を検出する。
[使用試薬]
酵素 :β- ガラクトシダーゼ (TOYOBO 社製)
グルコースデヒドロゲナーゼ(NAD 型)(TOYOBO 社製)
基質 :ラクトース一水和物 (ナカライテスク 社製)
緩衝液 :1 mM リン酸カリウム緩衝液 (pH 7.0)
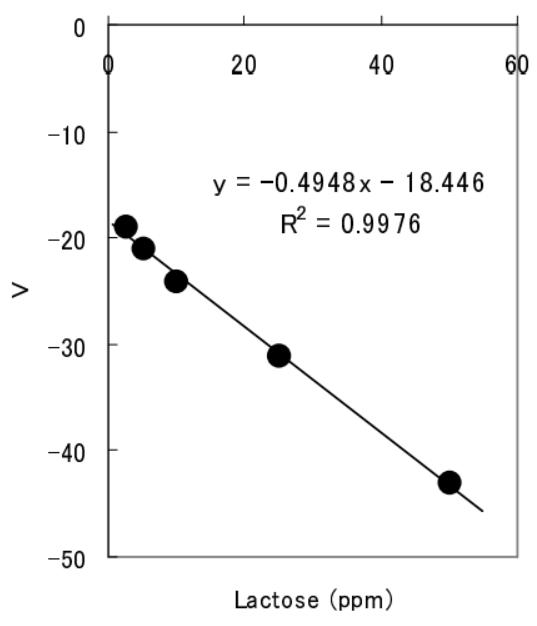
〔結果〕
ラクトース定量における公定法であるレイン・エイノン法は滴定といった熟練を要する手法を含むため、高い定量性を得るのは困難であるとされているが、AIMS-101 を用いた測定では酵素と試料(ラクトース)をセル内で混合 するだけでラクトースの定 量 的 測 定 が可能であった。
さらに、2.5 PPM といった微量なラクトースの検出が可能であることが明らかとなった。
飲料中の総ポリフェノール量の測定 (前処理を用いない直接測定)
AMIS-101 は反応におけるプロトンの変化を直接検出することから検体の色や濁度に左右されない。従って試料によっては前処理を省略して測定ができる。以下のデータは市販されている製品をそのまま前処理をせずに測定した結果である。
(1) 日本茶に含まれる茶カテキンの測定
[使用試薬]
酵素: ラッカーゼ
試料: 市販の日本茶
A: 超高濃度カテキン含有緑茶(1.54mg/ml)
B: 高濃度カテキン含有緑茶(0.85mg/ml)
C: 一般緑茶
〔結果〕
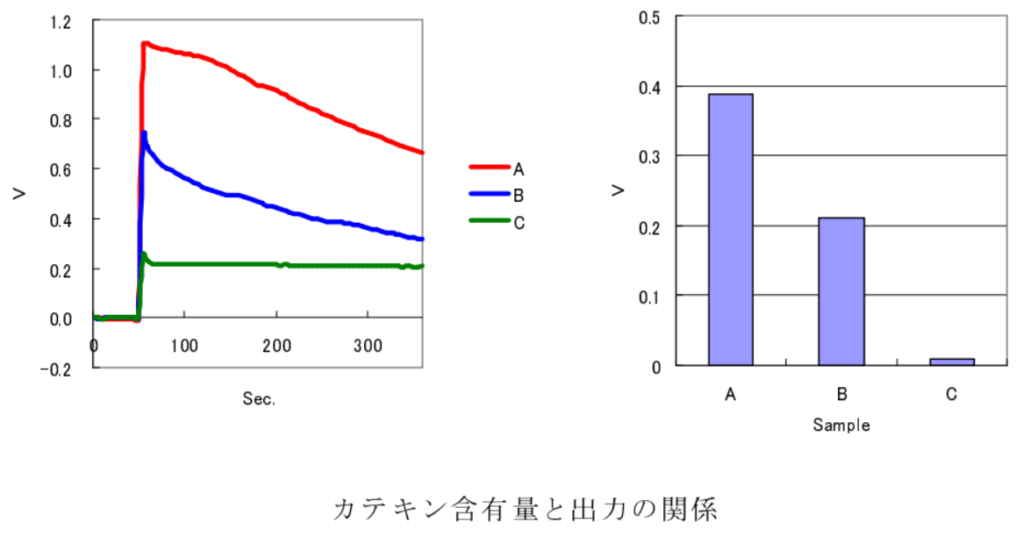
茶カテキン濃度の変化に伴う出力の変化が認められ、測定が可能であると考えられる。
ワインに含まれる総ポリフェノールの測定
[使用試薬]
酵素: ラッカーゼ
試料: ワイン(緩衝液で希釈)
緩衝液: 1 mM 酢酸緩衝液 (pH 5.0)
[結果]
基質濃度(ワイン)と出力の関係
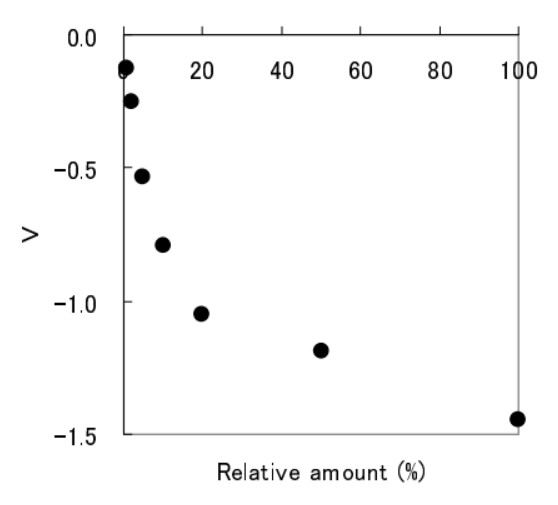
濃度は、製品(ワイン)を 100% としたと きの相対値を示している。
その他の測定事例
その他本測定装置の基本性能を示す測定例を下記に示す。一覧表に示す通り、幅広い範囲での応用が可能であることがわかる。
| 基質 | 酵素 | 補酵素 | 基質検出感度 (μM) | 酵素検出感度 (20μl中の絶対量) | 検出対象 |
| グルコース | Glucose Oxidase | 10μg/ml (55μM) | 0.5μg/ml (1ng) | 過酸化水素+グルコン酸 | |
| グルコース | Glucose Dehydrogenase | NAD | 20μg/ml (111μM) | プロトン | |
| グリセロール | Glycerol Kinase + Glycerophospate Oxidase | ATP | 1.5μg/ml (16μM) | 過酸化水素 | |
| エタノール | Alcohol Dehydrogenase | NAD | 10µg/ml (217µM) | プロトン | |
| ホルムアルデヒド | Formaldehyde Dehydrogenase | NAD | 0.3µg/ml (10µM) | プロトン+蟻酸 | |
| アセトアルデヒド | Aldehydel Dehydrogenase | NAD | 5ng/ml (0.1µM) | プロトン+酢酸 | |
| ATP | Alkaline Phosphatase | 5µg/ml (10µM) | 0.1unit/ml (0.002unit) | リン酸 | |
| 尿素 | Urease | 2µg/ml (33µM) | アンモニア | ||
| クレアチニン | Creatinine Deiminase | 1µg/ml (8.8µM) | 1μg/ml (2ng) | アンモニア | |
| オリーブ油 | Lipoprotein Lipase | 100µg/ml | オレイン酸 | ||
| リノール酸コレステロール | Cholesterol Esterase | 200µg/ml (300µM) | リノール酸 | ||
| DL-BAPNA | Tripsin | 60µg/ml | アルギニンカルボン酸 |

